研究シーズとそれを基に目指す製品・サービスの内容
1.シーズについて
- 現状と問題点
間葉系幹細胞は細胞採取に伴う倫理的問題が少なく、骨・軟骨・脂肪などへの多様な分化能を持つことから、造血幹細胞に次いで臨床応用が期待されている組織幹細胞である。比較的簡単な手技により分離できることから、主に試験管内で軟骨・骨などへ分化誘導後に局所へ移植するなど、バイオマテリアルの材料として広く用いられ、いくつかの施設では臨床治験が医師主導型で開始されている。また米国では300件以上の臨床試験が行われている(2004年矢野経済報告書より)。
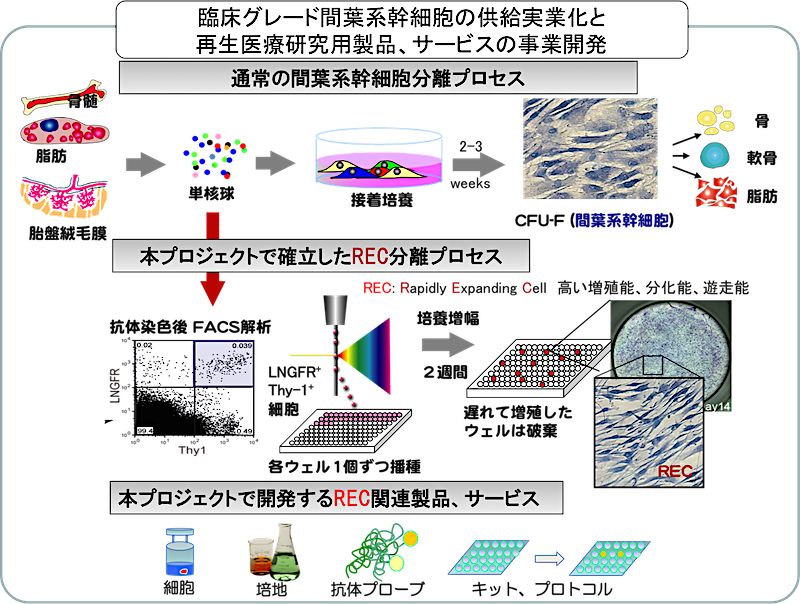
現在流通している間葉系幹細胞は、骨髄単核細胞を培養皿上に播種し、2~3週間培養後に出現する繊維芽細胞様のコロニー形成細胞(CFU-F)を回収するという方法で得る(下図)。
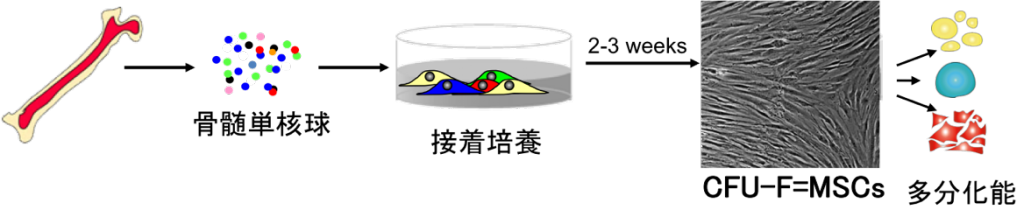 しかしこの手法で得た付着細胞集団にはいくつかの問題がある。
しかしこの手法で得た付着細胞集団にはいくつかの問題がある。
- 分化能:血球細胞や分化能が低いもしくは完全に失った夾雑細胞の混入が避けられず、実際に分化・増殖能を持つ未分化細胞(高品質MSC)は約1-3/1x103 という低頻度でしか含まれていない (Colter PNAS 2000)。
- 増殖能:初代培養細胞であるMSCは増殖回数に限界があり、通常は3-4回のパッセージ後には増殖性を失う。またその際、分化能も著しく低下している。
- 遊走能:培養増幅中に細胞の形質変化が起こり、骨髄内では遊走性を維持していたMSCが試験管内で培養するうちにその遊走性を失ってしまう(Rombouts Leukemia 2003, Morikawa J.Exp.Med. 2009)ため、経静脈投与による全身性疾患治療用途には使用不可である。
- ヒト骨髄に存在する高品質MSCの同定と分離方法開発
研究責任者の松崎らは文部科学省・再生医療の実現化プロジェクトを通じてLNGFR (CD271) Thy1 (CD90)の2種の抗体を用いることで極めて効率よくヒトMSCを選別することができることを明らかにし、骨髄・末梢血・胎盤絨毛膜・歯髄からセルソータを用いてヒトMSCを直接分離する技術を開発した(Mabuchi et al. Stem Cell Reports 2013)。
LNGFR Thy-1共陽性細胞(以下LT細胞)は6個中1個という極めて高頻度で線維芽細胞様コロニーを形成する。全骨髄単核細胞と比較し約3万倍のコロニー形成細胞が濃縮されており、世界で最も高い濃縮率を達成した分離方法である。
このLT細胞を96穴プレートに単一細胞分離後(B)に各ウェルの増殖速度を比較すると、2週間後にコンフルエントになる増殖が速いクローン(Rapidly Expanding Clone: REC)と、それ以外(Medium/Slow: MEC/SEC)に分類される(C)。
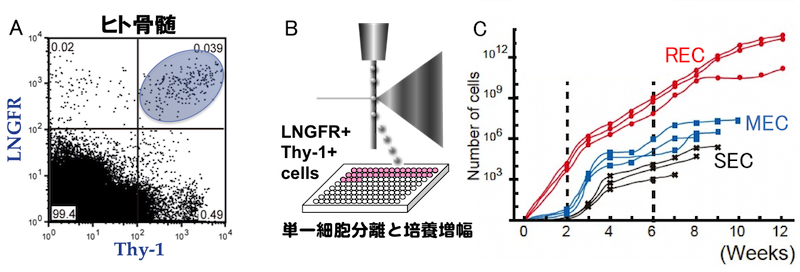 A: ヒト骨髄中のMSCはLNGFR Thy1共陽性分画(LT細胞)に存在する。 B: LT細胞の単一細胞分離。 C: LT細胞を単一培養して得たMSCクローンは増殖速度の差によって3つのグループに分類できる。RECはMEC/SECと比較し、A) 均一な細胞集団である、B)細胞老化を示していない、C) 細胞の大部分が増殖期にある、D) 高い分化能(特に脂肪分化能)を示す、E) 遊走性を示すなど、これまで問題となっている点をすべてクリアした高品質かつ高純度なヒトMSCと言える (Mabuchi et al. Stem Cell Reports 2013)。
A: ヒト骨髄中のMSCはLNGFR Thy1共陽性分画(LT細胞)に存在する。 B: LT細胞の単一細胞分離。 C: LT細胞を単一培養して得たMSCクローンは増殖速度の差によって3つのグループに分類できる。RECはMEC/SECと比較し、A) 均一な細胞集団である、B)細胞老化を示していない、C) 細胞の大部分が増殖期にある、D) 高い分化能(特に脂肪分化能)を示す、E) 遊走性を示すなど、これまで問題となっている点をすべてクリアした高品質かつ高純度なヒトMSCと言える (Mabuchi et al. Stem Cell Reports 2013)。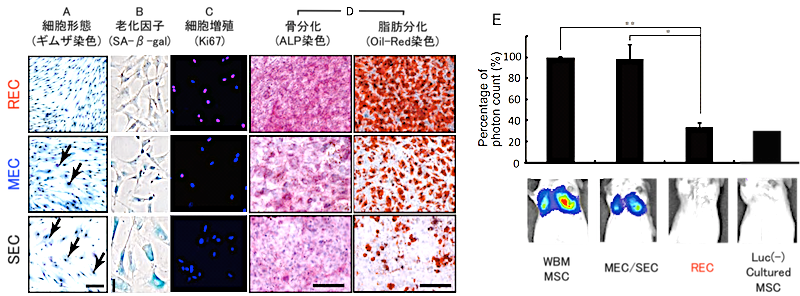 RECの細胞性能の特長 A: RECの細胞形態はサイズが小さく均一である。B: SA-β-galで染色されない新鮮な細胞である。C: RECの大部分が増殖期にある細胞マーカーであるKi67陽性である。D: 骨分化・脂肪分化共に良好である。E: 実験動物への経静脈投与後、肺毛細血管に補足された細胞が認められない。
RECの細胞性能の特長 A: RECの細胞形態はサイズが小さく均一である。B: SA-β-galで染色されない新鮮な細胞である。C: RECの大部分が増殖期にある細胞マーカーであるKi67陽性である。D: 骨分化・脂肪分化共に良好である。E: 実験動物への経静脈投与後、肺毛細血管に補足された細胞が認められない。 - 高純度ヒトMSC(REC)の分離概要
松崎らは骨髄のみならず脂肪組織および胎盤絨毛膜より同様の細胞集団を分離できることも明らかにしている。以上の結果を基に高純度MSC(=REC)を得る手順を確立した。
- 骨髄(または脂肪・胎盤絨毛膜)より単核細胞を調製
- 抗LNGFRとThy-1抗体で染色後LT細胞を96穴プレートに単一細胞ソーティング
- 2週間後にコンフルエントになったwellを選別(RECの選別)
- 細胞の回収と凍結保存
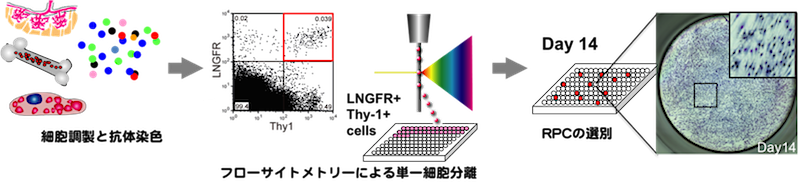 このプロトコルに準ずれば安定して高純度MSCが得られる(特願 2013-161752/ヒト間葉系幹細胞の分離培養法/松崎有未他3名)。さらに1 wellから回収した細胞を35mm培養皿に播種し7-10日間培養増幅すると、約5x106個の高い分化増殖能を持つ均一な細胞集団が得られる。一定期間の培養増幅後も分化・遊走能は維持されている。また、凍結細胞として保存が可能であり、研究用細胞としてすでに多数の研究施設に供与した実績を持つ。RECは細胞性能が極めて高く、ロット間の差がほぼ見られないことからユーザーの評判は非常に良好であり、正式に上市することで更なる発展が見込まれる。
このプロトコルに準ずれば安定して高純度MSCが得られる(特願 2013-161752/ヒト間葉系幹細胞の分離培養法/松崎有未他3名)。さらに1 wellから回収した細胞を35mm培養皿に播種し7-10日間培養増幅すると、約5x106個の高い分化増殖能を持つ均一な細胞集団が得られる。一定期間の培養増幅後も分化・遊走能は維持されている。また、凍結細胞として保存が可能であり、研究用細胞としてすでに多数の研究施設に供与した実績を持つ。RECは細胞性能が極めて高く、ロット間の差がほぼ見られないことからユーザーの評判は非常に良好であり、正式に上市することで更なる発展が見込まれる。
 (1) で述べたように、従来法で分離したMSC(CFU-Fとも呼ばれる)には細胞性能の極めて高いRECだけでなく、やや細胞老化が進んだMEC/SECが混在している(右図)。研究用・臨床用いずれもRECのみを対象とすべきであるが、RECのみを分離するには、研究責任者らが確立した単一細胞分離とクローン培養によらざるを得ない。セルソータによる単一細胞分離手技は専門性の高い技術であり、一般的に普及するにはいたらなかった。そこでRECを特異的に認識するマーカーとそれに対する抗体の作製が急務と考え以下の研究開発を行った。
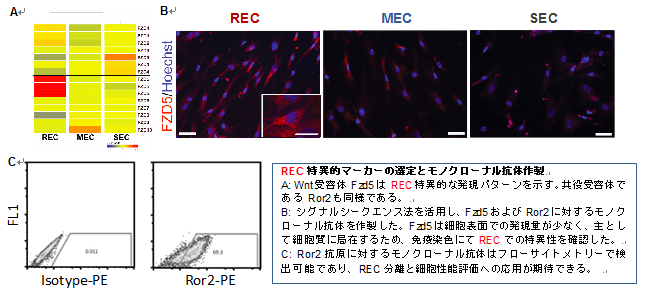
(1) で述べたように、従来法で分離したMSC(CFU-Fとも呼ばれる)には細胞性能の極めて高いRECだけでなく、やや細胞老化が進んだMEC/SECが混在している(右図)。研究用・臨床用いずれもRECのみを対象とすべきであるが、RECのみを分離するには、研究責任者らが確立した単一細胞分離とクローン培養によらざるを得ない。セルソータによる単一細胞分離手技は専門性の高い技術であり、一般的に普及するにはいたらなかった。そこでRECを特異的に認識するマーカーとそれに対する抗体の作製が急務と考え以下の研究開発を行った。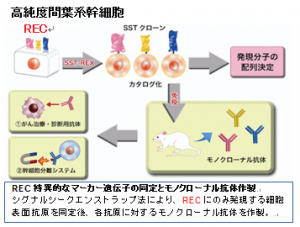 株式会社医学生物学研究所(旧株式会社ACTGen:2013年3月に合併)は、任意の細胞サンプルから膜蛋白質および分泌蛋白質遺伝子を網羅的に同定し、それらに対するモノクローナル抗体開発を行う特許技術(シグナルシークエンストラップ法:右図)を有している。本技術は細胞表面マーカーの遺伝子情報を得るだけでなく、最終目標である細胞分離用のモノクローナル抗体候補の連続的な開発も可能とするもので、研究責任者らの技術シーズを更に産業応用上意義の大きい成果に育てる産学連携プロジェクト(JST 顕在化ステージ)において、REC特異的な膜蛋白質の同定を行い、その内5種類についてモノクローナル抗体作製を行った(右図)。顕在化ステージ終了後の追加検討において、Fzd5およびその共役受容体Ror2について機能解析が完了し、RECの未分化性に必須の蛋白であること、発現がREC特異的であることなどが確認できている(下図)。
株式会社医学生物学研究所(旧株式会社ACTGen:2013年3月に合併)は、任意の細胞サンプルから膜蛋白質および分泌蛋白質遺伝子を網羅的に同定し、それらに対するモノクローナル抗体開発を行う特許技術(シグナルシークエンストラップ法:右図)を有している。本技術は細胞表面マーカーの遺伝子情報を得るだけでなく、最終目標である細胞分離用のモノクローナル抗体候補の連続的な開発も可能とするもので、研究責任者らの技術シーズを更に産業応用上意義の大きい成果に育てる産学連携プロジェクト(JST 顕在化ステージ)において、REC特異的な膜蛋白質の同定を行い、その内5種類についてモノクローナル抗体作製を行った(右図)。顕在化ステージ終了後の追加検討において、Fzd5およびその共役受容体Ror2について機能解析が完了し、RECの未分化性に必須の蛋白であること、発現がREC特異的であることなどが確認できている(下図)。
- 通常法で得たヒト骨髄由来MSC 現在商用に流通しているヒトMSCは、前述のように従来法である付着培養によって得られた細胞集団であり、凍結バイアル中に含まれる細胞のうちほとんどの細胞は分化能が低く、分裂速度が遅い上に分裂できる回数も限られている。また、培養条件、個々の手技によってはアウトプットにばらつきがでることはよく知られており、臨床応用に供する上で再現性を確保することが困難であることが大きな問題となっている。
- ヒト脂肪組織由来MSC 最近、ヒト骨髄由来MSCに近似した性質を示す細胞として、ヒト脂肪組織由来MSCが注目されており、骨髄由来と同様な凍結バイアルが流通しつつある。しかしその分離手法は上記骨髄由来MSCと同様、培養分離した夾雑物の多い細胞集団である上、骨髄由来MSCと比較し脂肪分化能に優れる反面、骨・軟骨分化能が低く、その用途が限られることが予想される。
- Muse細胞
Muse細胞は骨髄単核細胞をM-clusterと呼ばれる細胞塊状に培養して得た細胞であり、ES/iPS細胞同様に胚葉を超えた分化能を示すとされる(Kuroda, PNAS, 2010)。分化能の面ではヒト骨髄由来MSCを凌駕するが、反面、M-clusterの増殖性は極めて低く、ほぼ増殖しないため臨床に供するに足る細胞数の確保が困難であることが予想される。
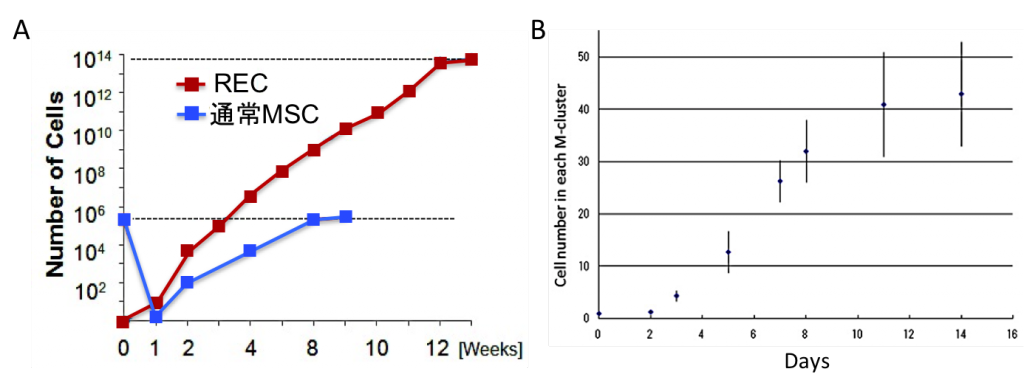 RECの細胞性能の特長(増殖性) A: RECは増殖性が極めて高い細胞集団であり、1個のRECから1x1012個まで培養増幅が可能である。同数の骨髄単核細胞から通常法得たMSCと比較し、1x106倍の細胞数が得られる。B: M-cluster中に含まれるMuse細胞の増殖性は極めて低く、2週間目には増殖が止まってしまうため、1個の細胞から40個のMuse細胞を得るのが限界である(PNAS 2010より)。
RECの細胞性能の特長(増殖性) A: RECは増殖性が極めて高い細胞集団であり、1個のRECから1x1012個まで培養増幅が可能である。同数の骨髄単核細胞から通常法得たMSCと比較し、1x106倍の細胞数が得られる。B: M-cluster中に含まれるMuse細胞の増殖性は極めて低く、2週間目には増殖が止まってしまうため、1個の細胞から40個のMuse細胞を得るのが限界である(PNAS 2010より)。 - 万能性幹細胞(ES細胞/iPS細胞)由来MSC
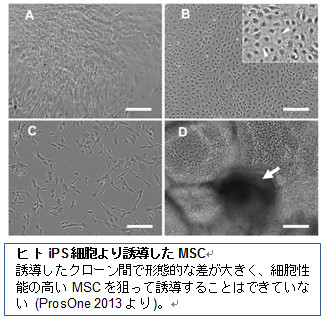 ES細胞あるいはiPS細胞から誘導したMSCに関する報告がいくつかなされている(Giuliani Blood 2011, Liu ProsOne 2013)。しかしながら、骨髄単核細胞からの分離同様、分化増殖遊走性にすぐれた均一な細胞集団を得るには至っておらず、また誘導・分離・培養に要する日数は骨髄単核細胞から分離する以上に必要である。さらに、未分化細胞の混入とそれによるテラトーマ形成等の危険性は未だ払拭されておらず、将来的に有望ではあるが現在までのところ実用性に乏しい段階である。
ES細胞あるいはiPS細胞から誘導したMSCに関する報告がいくつかなされている(Giuliani Blood 2011, Liu ProsOne 2013)。しかしながら、骨髄単核細胞からの分離同様、分化増殖遊走性にすぐれた均一な細胞集団を得るには至っておらず、また誘導・分離・培養に要する日数は骨髄単核細胞から分離する以上に必要である。さらに、未分化細胞の混入とそれによるテラトーマ形成等の危険性は未だ払拭されておらず、将来的に有望ではあるが現在までのところ実用性に乏しい段階である。
2.シーズを基にした製品・サービスの内容
- 高純度間葉系幹細胞の凍結バイアルの製品化と受託サービスの整備 松崎らが独自に開発した細胞分離技術を用いて精製した高純度の間葉系幹細胞を凍結バイアルに封入し、研究用途の間葉系幹細胞製品として商品化する。さらに、移植医療への適合を視野に入れ、細胞性能が保証され、GMPに準拠したレベルの高純度な幹細胞を安定的に提供する体制を整備し、臨床用高純度MSC分離システムを構築し、臨床施設への細胞分離・培養受託サービスを提供する。
- 間葉系幹細胞分離用・評価用試薬、細胞培養用試薬
顕在化ステージで新規に作製した高純度間葉系幹細胞に特化した染色性を示すモノクローナル抗体のうち、細胞分離に適した候補はナノ磁気微粒子と結合させることによって、間葉系幹細胞分離用試薬として事業化する。また、分離した間葉系幹細胞の品質を検定するためには、細胞評価用の試薬が必要となる。移植用間葉系幹細胞の細胞品質評価用試薬として、蛍光物質結合抗体、細胞染色用試薬を事業化する。さらに、間葉系幹細胞を医療へ応用する際、自己増殖能と分化能を有するには安定的な培養環境が必要となる為、最適化された細胞培養用試薬もあわせて提供する。
- 高純度な間葉系幹細胞
既述したように、間葉系幹細胞移植医療は、すでに臨床応用はされているものの、既存の手法で分離された細胞は幹細胞としてはわずか0.1-1%が含まれているにすぎず、純度に課題が残る。再生医療の市場は「間葉系幹細胞関連の国内再生医療市場予測((株)矢野経済研究所:2004 年度)」によると、2010 年に112,000 件、2015 年に218,720 件と予想されている。今後、先進諸国の高齢化が進むとともに、さらに患者数が増え続けるものと考えられる。また、米国では再生医療関連の市場は2020 年には6,000億円に成長すると推定されており、高純度間葉系幹細胞を用いた再生医療への社会的貢献、社会経済への効果は大きいものと予想される。
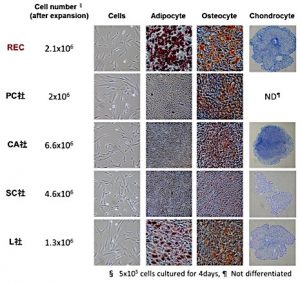 右図に実際に現在市販されている4社の製品(凍結ヒト骨髄由来MSC)とRECを比較したデータの一部を紹介する。5×106 cellsの細胞を4日間培養した際、RECは、細胞の増殖速度では、5細胞中3番目と普通の成績であるが、上位に位置するCA社とSC社は脂肪への分化能がなく、完全なるマルチ分化能を有していない。また、REC細胞と同等の増殖率であるPC社の細胞は、骨への分化能しか有していなかった。このように、市場に流通しているヒト骨髄由来MSCは増殖能や分化能が様々で、ロット間・製品間の品質の差が大きく、研究に供する場合には実験精度および再現性に影響を及ぼす。臨床的に見た場合、治療効果の面で安定性に欠ける。RECを市場に乗せることは、現在広く使われているMSC細胞の課題を全て克服できるため、優位性が高いものと考えている。
右図に実際に現在市販されている4社の製品(凍結ヒト骨髄由来MSC)とRECを比較したデータの一部を紹介する。5×106 cellsの細胞を4日間培養した際、RECは、細胞の増殖速度では、5細胞中3番目と普通の成績であるが、上位に位置するCA社とSC社は脂肪への分化能がなく、完全なるマルチ分化能を有していない。また、REC細胞と同等の増殖率であるPC社の細胞は、骨への分化能しか有していなかった。このように、市場に流通しているヒト骨髄由来MSCは増殖能や分化能が様々で、ロット間・製品間の品質の差が大きく、研究に供する場合には実験精度および再現性に影響を及ぼす。臨床的に見た場合、治療効果の面で安定性に欠ける。RECを市場に乗せることは、現在広く使われているMSC細胞の課題を全て克服できるため、優位性が高いものと考えている。 - 臨床用REC受託サービス 医療機関が再生医療用細胞の培養加工を外部に委託するのを認める「再生医療等安全性確保法」の施行により、細胞の培養加工について定める安全基準に適合する施設や作業手順を整えることで、受託サービスの展開が容易になった。大学病院などの臨床施設が患者から採取した骨髄(あるいは胎盤絨毛膜・脂肪組織)よりRECを分離後、GMPに準拠した培養条件で増幅し、移植治療の臨床研究に活用してもらう。供給先の臨床施設と研究成果を共有し、細胞の品質管理や品質評価、品質規格の設定に関するノウハウを蓄積し、再生医療製品として薬事承認に向けた今後の臨床開発に生かす。すでに臨床用MSCの分離実績を持つ産総研よりCPC内での細胞培養手順その他のノウハウは島根大学病院輸血部へ技術移転が完了しており、大学病院内に設置されたアイソレーターによるGMPレベルでの通常MSCの培養操作と手順は確立されている。本プロジェクトを通じて閉鎖系でのREC分離手順を確立することで、受託施設として稼働させることを目標にする。
- 間葉系幹細胞の品質評価用抗体 従来の低分子医薬とは異なり、製造バッチごとに異なる組織提供者(ドナー)に由来する細胞を用いる細胞医療においては、製剤の規格化が困難であることが認識されている。特定の分子量、特定の構造式といった物理化学的な手段でその主製剤の特定ができないことが、製剤の規格化を考える上で、細胞と低分子薬で最も大きな相違点である。細胞医薬は細胞自体が主製剤であるため、ドナーに由来する違い、製造工程の影響を受けるなどの面から、規格化が極めて重要となる。したがって、間葉系幹細胞を均質なグレードで製造するための指標となるマーカーの開発は急務であり、臨床効果に直結する遺伝子発現については特に管理が必要となる。間葉系幹細胞の定義の1つとしてCDマーカーが利用されているが、それらと組み合わせて、細胞機能に必須の機能性マーカーを製造工程や出荷試験の規格に導入することで、細胞の機能性の規格化が可能となる。この目的に対し、申請者らが作製したMSCの未分化性維持に関わる遺伝子群に対するモノクローナル抗体は極めて有望と考えている。
